来源:Vaccine前沿
疫苗的免疫保护作用,即接种疫苗后机体抵御病原体感染的能力,是衡量疫苗有效性的关键。根据疫苗用途和接种目的不同,衡量疫苗保护性的指标和机制也不尽相同。
预防性疫苗(prophylactic vaccine)主要目的是在病原体感染细胞或病原毒素黏附细胞之前阻止病原和毒素入侵,因此,诱导中和抗体最为关键;
治疗性疫苗(therapeuticvaccine)针对已感染、因免疫耐受而无法清除病原的慢性感染患者或肿瘤患者,中和抗体显然无法作用于胞内病原,因此,细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)及CD4Th1细胞活化则成为评价治疗性疫苗的重要指标。
近年,固有免疫对适应性免疫的启动和调节功能倍受重视,新型疫苗设计的核心之一在于DC激活,而固有免疫信号通路对于DC激活十分关键,成为新型疫苗佐剂设计的重要基础。
固有免疫细胞的功能及在疫苗设计中的应用
固有免疫细胞包括吞噬细胞(中性粒细胞和单核吞噬细胞系统)、DC、γδ T细胞、NK细胞、NK T细胞、B-1细胞、肥大细胞等。固有免疫细胞通常富集于黏膜表面、皮下和腹腔,是感染或危险发生的早期和初始部位,通过有限的PRR识别病原共有的PAMP或DAMP,启动快速而广泛的免疫应答,有效限制感染的程度和阻止病原体扩散。固有免疫应答不仅是机体抵御微生物侵袭的第一道防线,同时也密切参与并影响适应性免疫应答的启动、进程和效应。
吞噬细胞
吞噬细胞(phagocyte)包括中性粒细胞和单核吞噬细胞系统,是参与固有免疫早期应答的主要效应细胞。中性粒细胞(neutrophil)占人体外周血白细胞总数的60%~70%,细胞质含独特的嗜苯胺蓝颗粒(胰蛋白酶、髓过氧化物酶等)。
局部细菌或病毒感染时,中性粒细胞在1~3小时内迅速穿越血管内皮细胞进入感染部位,通过表面IgGFc和补体C3b受体,经调理吞噬,合成ROS等促进杀菌作用(对病毒似无直接作用)并分泌TNF等促进炎症吸收。
活化的中性粒细胞还形成胞外诱捕网(neutrophil extracellular trap,NET),NET 结构富含 DNA、组蛋白、抗菌肽、S100A8和S100A9等,有助于限制细菌扩散。
肿瘤浸润淋巴细胞内,有一类特殊的髓系来源抑制细胞(myeloid-derived suppressor cell,MDSC),发挥肿瘤局部抑制功能,其中的主要成分之一是中性粒细胞。
新型肿瘤疫苗设计中,以S100A9抑制剂(Tasquinimod)作为前列腺癌治疗和治疗性疫苗的辅助成分,发现可显著抑制肿瘤局部MDSC的富集,从而提高特异CD8+T细胞应答的诱导(Mehta and Armstrong, 2016)。
外周血单核细胞(monocyte,Mon)是外周血感染的监视和效应细胞,更是局部组织感染后浸润巨噬细胞、DC的主要补给来源;巨噬细胞(Mø)因其出色的抗原摄取、抗原提呈和炎症因子分泌功能,成为疫苗抗原的靶向细胞。因巨噬细胞表面高度表达甘露糖受体(mannose receptor,MR)和补体受体(CR)并介导抗原内吞,在疫苗抗原或疫苗颗粒表面偶联甘露糖或补体片段,故经免疫后的疫苗或疫苗抗原可通过MR和CR的特异性结合与内吞,有效提高疫苗抗原被巨噬细胞和DC特异结合与摄取的概率,显著增强疫苗在体内的摄取表达效率与免疫原性(Chattopadhyayetal.,2016;He et al. , 2015)。
外周血单核细胞(monocyte,Mon)及组织内巨噬细胞(Mф)组成单核-吞噬细胞系统(mononuclear Phagocyte system,MPS),具很强的抗原摄取能力,富含溶酶体酶、溶菌酶等。感染1~2小时内,外周血单核细胞可迁移至感染局部,与局部巨噬细胞发挥吞噬、杀菌功能,在吞噬溶酶体中合成反应性氧中间物(ROI)和NO杀菌;并由PRR识别病原来源PAMP成分,激活胞内信号,诱导1型干扰素、炎症细胞因子、趋化因子的分泌。趋化因子诱导外周血内更多单核细胞和T细胞迁移至组织局部。
树突状细胞(DC)
DC是抗原提呈能力最强的APC,占外周淋巴细胞的比例小于1%,;是唯一能够活化初始Th(Th0)细胞的APC。组织局部的DC摄取抗原,处理提呈抗原的同时,向引流淋巴结移动,过程中上调表达MHC-II类分子和共刺激分子(CD80、CD86和CD40),在引流淋巴结激活T细胞。DC分为经典DC(conventional dendritic cell, cDC)和浆细胞样 DC(plasmacytoid dendritic cell,pDC)。
肠道和肺 cDC又分为eDC1(CD103+CD11b-)和eDC2(CD103+CD11b+,又称髓系DC,mDC)亚群。
cDC:在不同组织局部摄取、提呈抗原,是激活特异T细胞应答的优势APC。
pDC:识别病毒感染或自身抗原,产生大量的1型干扰素,在抗病毒免疫及自身免疫炎症损伤中发挥独特作用。
基于DC是功能最强大的APC,而特异性T细胞应答的激活必需DC的抗原提呈与共刺激信号,在普遍存在DC免疫耐受的病毒持续感染和肿瘤患者体内,针对DC的数量和功能激活,制备以DC为基础的DC荷肽疫苗,成为慢性感染疾病和肿瘤预防及治疗性疫苗设计的重要策略。这一疫苗设计中,关键在于抗原特异性T细胞表位的选择和高效激活DC功能的佐剂的联合。
由于精确靶向了T细胞表位肽、体外令DC有效处理提呈,同时通过佐剂显著激活DC的活化、共刺激分子表达及凋亡的减少,DC荷肽疫苗有助于显著激活抗原特异性ThI细胞应答和CTL应答,在肿瘤治疗性疫苗设计中独受青睐(FilleyandDey, 2017)。
在血液肿瘤免疫治疗方面,利用异基因干细胞移植,通过激发移植物抗宿主应答,有利于杀伤血液恶性增殖细胞,临床发现效果很容易反弹,提示杀伤反应的不足。近期研究发现,供者来源造血干细胞前体细胞来源的髓系DC(BDCA1+mDC)和pDC体外增殖富集,作为DC疫苗再输注患者,发现具有有效激活肿瘤反应性CD8+T细胞和NK细胞的杀伤应答。其中,BDCA1+mDC和pDC均显著激活经干细胞移植后的肿瘤特异CD8+T应答;而pDC则可更显著激活NK细胞活化和杀伤效应(TRAIL上调),提示以mDC和pDC为基础的治疗性疫苗作为异基因干细胞移植后的巩固性治疗在消除血液肿瘤方面具有潜力(Thordardottir et al.,2017)。
γδ T细胞
γδ T细胞占外周血T细胞的5%~10%,皮肤、肠道黏膜中较多。其TCR多态性有限,抗原识别无MHC限制,抗原识别谱窄,主要识别分枝杆菌等胞内菌的热休克蛋白(heatshock protein,HSP)、CDI递呈的非多肽抗原(如分枝杆菌的脂类抗原)、某些磷酸化抗原以及疱疹病毒等蛋白质抗原,类似于NK细胞,γδ T细胞具有对肿瘤和胞内菌的杀伤功能。γδ T细胞在皮肤黏膜局部的抗胞内菌和病毒固有免疫防御中发挥重要作用,如结核分枝杆菌的肺支气管感染与清除均与肺γδ T细胞激活及效应显著相关γδ T细胞还通过分泌IFN-y、IL-17A等细胞因子发挥免疫调节作用。
基于γδ T细胞不依赖MHC的肿瘤杀伤活性,目前发展了若干以γδT细胞为基础的肿瘤防治策略,如体外扩增 γδ T细胞再回输,以及体内以IL-2、双磷酸盐、抗肿瘤单抗(如Rituximab、Trastuzumab)处理,旨在激活、趋引和扩增γδ T细胞,以促进其抗肿瘤效应。
近期发现,以DC为基础的肿瘤治疗性疫苗,其有效性也显著依赖于或协同增强 γδ T细胞效应。以不同激动剂或药物处理DC,可有效激活 γδ T细胞分泌抗肿瘤细胞因子,增强其杀伤功能,因此,可显著增强DC荷肽疫苗在肿瘤免疫治疗方面的效果。
如用唑来磷酸处理DC,可使其释放磷酸抗原,从而激活T细胞分泌IFN-γ、TNF-α,促进Thl细胞应答:肽聚糖、poly Ⅰ:C、LPS、R848、CpG以及BCG均可激活pDC促进人Vγ9δ2T细胞分泌IFN-γ。用唑来磷酸处理DC,可显著促进T细胞上调,表达杀伤活性受体NKG2D。部分经TLR激动剂处理后的DC也可促进T细胞内颗粒酶B的释放和增强其杀伤效应。T细胞是否可被有效动员和激活杀伤效应成为肿瘤治疗性DC疫苗有效性的评估指标之一(Van Acker et al. , 2015)。
NK细胞和NK T细胞
自然杀伤细胞(natural killercell),即NK细胞,因其无需预先刺激就可天然杀伤肿瘤细胞而得名。NK细胞杀伤肿瘤细胞不依赖MHC,而通过识别缺失或下调表达MHC-I类分子的病毒感染细胞或肿瘤细胞["丢失自我"(missing-self)机制],以及膜表一系列杀伤激活受体(KAR)和杀伤抑制受体(KIR)的平衡调节其杀伤活性(图1)。

图1.NK细胞免疫识别的丢失自我机制
生理状况下,NK细胞表面杀伤抑制受体(KIR)与正常细胞表面表达的MHC-I类分子结合、转导抑制性信号,抑制NK细胞活化,不发生攻击。病毒感染或肿瘤发生时,靶细胞表面的MHC-I类分子水平下调或丢失,NK细胞表面KIR与之结合产生的抑制性信号减弱或消失,则NK细胞被活化,发挥杀伤效应。
NK细胞可通过直接杀伤(释放穿孔素和颗粒酶使靶细胞凋亡)、表达膜TNF家族分子(FasL、TRAIL、mTNF等与靶细胞膜配体结合,诱导靶细胞凋亡)和抗体依赖的细胞介导的细胞毒性作用(ADCC)发挥杀伤效应。CD56brightNK细胞可分泌IFN-γ、TNF-α、GM-CSF、IL-10等,发挥免疫调节功能。基于细胞强大的天然杀伤肿瘤活性,以NK细胞体外增殖活化并回输的肿瘤免疫治疗成为肿瘤防治的热点领域。
目前,主要以IL-2、IL-12、IL-15、IL-18、IL-21体外对NK细胞予以充分活化增殖,通过自体NK细胞或异基因NK细胞治疗白血病等肿瘤。为克服肿瘤微环境的免疫抑制,通过上调KAR表达,使用免疫检查点抑制剂(check point inhibitor)如 anti-PD-L1、使用免疫激活剂[如来那度安(Lenalidomide)]上调NK细胞表面杀伤受体TRAIL的表达、使用嵌合T细胞抗原受体(CAR)改造NK细胞、偶联肿瘤特异单抗提高靶向性等策略,来综合提高基于NK细胞的肿瘤治疗效果(Dahlbergetal.,2015)。
自然杀伤性T细胞(nature killer T cell,NK T细胞)表达多样性有限的TCR(TCRα链唯一,TCRβ链有限)。抗原识别谱较窄,识别由CDId分子提呈的脂类抗原[如半乳糖神经酰胺(α-GalCer)],激活后分泌大量IFN-γ、IL-4以及Th17细胞因子,功能类似Th细胞,可显著促进DC成熟和T细胞应答。通过微米颗粒表面负载含α-GalCer的脂质双层,并偶联DC表面受体相应配体(如糖类)制备疫苗,通过靶向DC提呈α-GalCer并在体内激活NKT细胞,显著抑制肺癌的转移。
此外,还发展了DC转染HER2抗原并负载a-GalCer疫苗、肿瘤细胞转染α-GalCer疫苗、稳转CD1d的HEK细胞负载α-GalCer并表达人黑色素瘤MART-1抗原的人造APC-肿瘤抗原或NKT细胞激活型疫苗等策略,来充分利用NKT细胞的佐剂功能,用于增强抗实体肿瘤T细胞应答的治疗效果(Faveeuwand Trottein,2014)。
B-1细胞
B-1细胞系固有免疫细胞,占B细胞总数的1%~5%,分为CD5+的B-1a和CD5-的B-1b细胞亚群。
B-1a细胞:为腹腔优势B-1细胞(仅小鼠),除维持免疫自稳,还在抗流感病毒感染中通过诱导天然抗体、在肺局部富集并诱导多特异性的IgM和IgA为主的抗体发挥保护性功能;
B-1b细胞:具有BCR连接多样性较高、抗原谱更广的特点,通过识别肺炎球菌荚膜多糖和伤寒沙门氏菌Vi蛋白抗原,产生中等亲和力IgM,在小鼠体内发挥抗感染保护作用。Borrelia螺旋体感染小鼠后,外周血细菌载量极高而脏器载量则较低,证实虽IgG也提供一定保护,但抗感染保护主要来自B-1b细胞针对H因子结合蛋白(fHbp)诱导的特异性记忆性IgM应答。肺炎链球菌荚膜多糖诱导的B-1b抗体应答也提供了免疫保护。
证据表明,针对细菌多糖的保护性记忆应答均依赖B-1b细胞,且B-lb细胞保持对细菌多糖的终身回忆反应,提示易感肺炎链球菌的老年人(即使接种了多糖偶联疫苗pneumovax)更适合接种特定而高效的B-1b抗原疫苗,以获得终身保护。伤寒沙门氏菌Vi蛋白抗原已被用于人体疫苗的研制,Vi也被证实为保护性B-1b抗原,通过诱导B-1b抗体应答提供免疫保护。
上述进展提示,天然感染中的、若干TI-II抗原所激活的、B-1b介导的中等亲和力和多反应性IgM应答,也可单独提供免疫保护,或是常规B-2细胞介导免疫保护所不可缺少的黏合剂。B-1b细胞及B-1b抗原可更多地被考虑用于人类预防性疫苗、治疗性疫苗的研制(Cunninghametal.,2014)。
固有免疫分子的功能及在疫苗设计中的应用
体液中天然预存有许多具有抗感染效应的蛋白和分子,包括补体系统、细胞因子、抗菌肽等。
补体系统
补体是生物体内最古老的固有免疫防御系统之一,包括30余组分,广泛存在于血清、组织液,可分为补体固有成分、补体调节蛋白和补体受体(CR)。
补体固有成分包括Clq、Clr、Cls、C2、C4(经典激活)、B因子、D因子和备解素(properdin,P因子)(旁路激活),甘露糖结合凝集素(mannose-binding lectin,MBL)、MBL相关丝氨酸蛋白酶(MBL-associ-atedserineprotease,MASP)(MBL途径)和补体活化共同组分C3、C5、C6、C7、C8、C9等。
补体固有成分天然存在于体液,通过3条补体激活途径发挥抗感染功能(图2)。
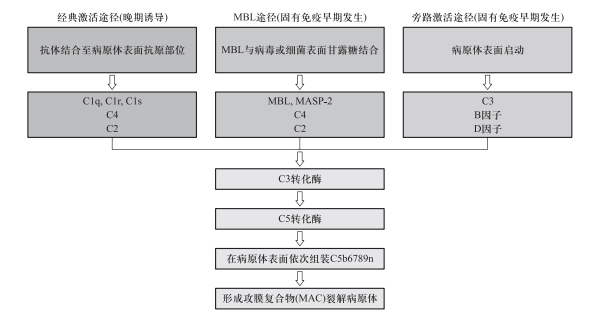
图2.补体的激活途径
1.经典激活途径:抗原特异性IgG、IgM结合于微生物膜表面,Fe段与Clq结合,顺序活化Clr、Cls、C2、C4、C3,形成C3转化酶(C4b2a)与C5转化酶(C4b2a3b),依次活化裂解C5、C6、C7、C8、C9,形成C5b6789n攻膜复合物(membraneattackcomplex,MAC),在靶细胞膜形成亲水性孔道,致胞内渗透压降低、电解质紊乱而崩解。
2.旁路激活途径(alternative pathway):由某些细菌、内毒素、酵母多糖、葡聚糖或外源异物直接激活C3,在B因子、D因子和备解素参与下,形成C3和C5转化酶。
3.MBL途径:血浆中以甘露聚糖、甘露糖胺等为末端糖基的凝集素或纤维胶原素等,可结合多种病原体表面的MBL,依次活化MASP、C4、C2、C3,形成C3与C5转化酶。
3条途径起点各异,存在相互交叉,具有共同的末端过程。补体的旁路激活途径和MBL途径早于经典激活途径发生,为抗感染免疫的第一道防线。旁路激活途径是进化中最早出现的补体活化途径,在特异性抗体产生之前,由病原微生物糖链组分等触发形成MAC破坏病原体,所产生的C3a片段还可发挥调理、吞噬炎症等功能而发挥抗感染作用。
细胞因子
细胞因子(cytokine)是小分子量[(8~30)x103]的、由免疫细胞及组织细胞分泌的、具广泛细胞调节作用的小分子可溶性蛋白,与特异性细胞因子受体结合,调节细胞增殖分化、凋亡、炎症,具有多效(pleiotropy)、重叠(redundaney)、协同(synergy)、交互(network)、拮抗(antagonism)等作用特点。
已发现的200余种人类细胞因子,根据其结构和功能可分为:
①白细胞介素(interleukin,IL);
②集落刺激因子(colony-stimulatingfactor,CSF);
③干扰素(interferon,IFN);
④肿瘤坏死因子;(tumor necrosis factor,TNF);
⑤生长因子(growth factor,GF);
⑥趋化因子(chemokine)。
IFN因其有干扰病毒复制的功能而得名。IFN可分为I型和II型干扰素。
I型干扰素:包括IFN-α、IFN-β,由病毒感染的细胞产生,作用于邻近细胞,激活细胞合成RNaseL和蛋白激酶PKR,抑制病毒转录和复制;更重要的是,IFN-α、IFN-β与免疫或组织细胞表面IFNR作用,诱导多种I型干扰素诱导基因(ISG)的表达,实现抗病毒作用。
II型干扰素:为IFN-γ,由活化T细胞和NK细胞产生,激活T细胞效应,具有抗病毒、抗肿瘤和免疫调节等作用。
细胞因子因其广谱的免疫细胞激活和调节功能,如趋化因子对免疫细胞及肿瘤细胞有定向趋引功能、干扰素有强大的抗病毒复制与免疫调节功能、集落刺激因子和生长因子对免疫细胞增殖、分化具有必不可少的支持功能,被广泛应用于疫苗佐剂的研制。
抗菌肽
抗菌肽(antimicrobial peptide,AMP)系多物种保守表达的具有天然广谱抗微生物活性的小分子多肽,在哺乳动物中分为防御素(defensin)和cathelicidin家族。
1.防御素:含有29~42个氨基酸的小蛋白,存在于从植物、低等动物到哺乳动物等几乎所有生物中,对细菌、真菌和有囊膜病毒具有直接杀伤作用。根据其二硫键位置可分为α-防御素、β-防御素、θ-防御素。
防御素可通过正电荷多聚体穿孔原理破坏细菌和包膜病毒的细胞膜,还有趋化DC和T细胞作用。α-防御素为阳离子多肽,主要由中性粒细胞和小肠Paneth细胞产生,可调节肠道菌群,破坏肠道细菌和病毒膜结构,或直接结合细菌毒素和蛋白阻断其功能,但也可通过影响病毒吸附等加速HIV的感染。

2.cathelicidin:表达于多种组织细胞(上皮细胞、角质细胞、胰岛细胞)和免疫细胞(中性粒细胞、巨噬细胞、肥大细胞等),其以无活性前体形式合成,剪除N-端信号肽后成为活性成熟肽。人和小鼠的cathelicidin分别为LL-37和CRAMP。
cathelicidin可天然抑制革兰氏阳性和阴性菌、真菌和多种包膜病毒(呼吸道合胞病毒、流感病毒),其机制为抗菌肽正电荷与微生物带负电荷的膜结构静电吸引并以α-螺旋破坏细胞膜完整性导致微生物死亡;还可阻断脂多糖(LPS)与LPS结合蛋白的结合及其炎症作用。
cathelicidin的广谱抗微生物活性使当前国际上以哺乳动物抗菌肽cathelicidin为模板开发的肽类抗生素Iseganan、Omiganan成为热点,并已进入临床试验阶段。抗菌肽cathelicidin还对免疫细胞和非免疫细胞发挥多样的免疫调节功能,包括趋化中性粒细胞、单核-吞噬细胞系统,直接激活炎症细胞分泌促炎细胞因子,激活上皮细胞或角质细胞抗病原菌应答等。
临床研究发现,出生后24小时内注射BCG的新生儿和口服脊髓灰质炎疫苗的新生儿,于6周后显著诱导肠道LL37抗菌肽的增高表达,与疫苗的免疫保护具相关性。基于其广谱抗病原功能、趋化和免疫调节功能,抗菌肽是替代抗生素的理想抗感染小分子药物,也是应用于疫苗佐剂的候选物质(Chungand Khanum, 2017)。
固有免疫信号激活应用于疫苗佐剂的设计
皮肤黏膜的固有免疫细胞对感染、损伤和突变自身的快速广泛应答,构成人类免疫的第一道防线。固有免疫应答的核心是固有免疫细胞通过一系列位于膜表、细胞质、内体膜表的PRR来识别病原微生物、损伤组织成分、肿瘤抗原共有的保守结构——病原体相关分子模式(PAMP)、机体细胞凋亡、损伤和代谢改变等产生的损伤相关分子模式(DAMP)等。
PAMP和DAMP也被称为固有免疫原。
1.PAMP:为进化保守的微生物基本结构及成分,如革兰氏阴性菌的脂多糖(lipopolysaccharide,LPS)、革兰氏阳性菌的脂磷壁酸(lipoteichoic acid,LTA)和肽聚糖(pepti-doglycan,PGN)、微生物细胞壁的成分甘露糖、真菌的酵母多糖、细菌的非甲基化CpG DNA序列、病毒所产生的单链或双链RNA(singleordouble-strandedRNA,ss/dsRNA)等。
2.损伤相关分子模式(DAMP):也称为内源性危险信号(endogenous danger signal),通常由环死细胞或应激细胞释放,介导非感染状态下的无菌性炎症。DAMP家族成员包括:透明质酸钠(hyaluronan)片段、热休克蛋白(HSP)、S100家族蛋白、B淀粉样蛋白(amyloid-β)细纤维、尿酸(uricacid)、ATP、核相关蛋白如高迁移率组盒蛋白1(HMGB1)、某些细胞因子如IL-1α和IL-33等,以及脂类代谢产物氧化低密度脂蛋白(OXLDL)、氧化胆固醇酯(oxidizedcholesteryl ester,OXCE)和饱和脂肪酸、β半乳糖苷结合凝集素(galectin)等。
大部分DAMP来源于胞内物质,少数来源于胞外基质成分如透明质酸钠。其中,HMGBl是重要的损伤细胞和肿瘤缺氧条件下释放的危险信号,介导促炎细胞因子TNF、IL-6等的释放,介导多种自身免疫疾病和肿瘤相关炎症。DAMP的受体包括TLR2、TLR4和晚期糖基化终末产物受体(RAGE)等。
PRR非克隆性表达于多种固有免疫细胞(特别是巨噬细胞、DC等专职APC)表面或细胞质。PRR包括三大类(图3):
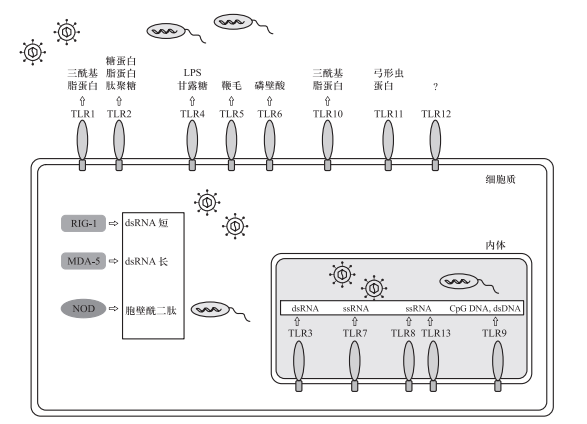
图3.固有免疫PR对于PAMP的识别
1.分泌型PRR:血液和淋巴液中的循环分子,如C-反应蛋白,作为急性期蛋白可结合细菌细胞壁的磷脂酰胆碱;甘露聚糖结合凝集素(MBL)可识别并结合细菌、酵母菌及某些病毒表面的甘露糖组分,通过激活补体、促进调理吞噬,促进对病原体的清除。
2.内吞型PRR:结合病原微生物PAMP、介导吞噬溶酶降解的吞噬细胞表面跨膜受体。包括:巨噬细胞的甘露糖受体(MR),可识别微生物细胞壁的甘露糖和岩藻糖残基,介导细胞吞噬作用;巨噬细胞的清道夫受体(scavenger receptor,SR),可识别氧化的低密度脂蛋白、LPS、LTA、整个细菌以及凋亡、损伤细胞等,吞噬清除入侵病原体和损伤细胞。
3.信号转导型受体:包括膜型(细胞膜、内体膜、溶酶体膜)和胞质型受体,如Toll样受体(Toll-likereceptor,TLR)、维A酸诱导基因I样受体[retinoic-acid-inducible gene I(RIG-I)-like receptor,RLR]和核苷酸结合寡聚化结构域样受体家族( nucleotide-binding oligomerization domain ( NOD) -likereceptor,NLR)。
上述受体识别各种PAMP和DAMP后,启动特定信号转导通路,诱导一系列相关的基因表达,激活I型干扰素及诱导基因效应、炎症细胞因子和趋化因子表达等,同时上调APC表面的MHC和共刺激分子,激活抗原提呈和T细胞应答。
TLR是识别PAMP的主要代表性PRR。已发现哺乳动物有13种TLR,TLR属1型跨膜蛋白,在胞外区负责识别PAMP;胞内段含有信号转导元件,可与胞内接头蛋白相互作用,启动信号传递。13种TLRs可识别来源于病原微生物的多种保守成分,也可识别DAMP如热休克蛋白、纤维蛋白原、透明质酸等。

TLR识别PAMP后,启动一系列胞内级联信号活化,包括MyD88依赖(myeloiddifferent factor 88dependent)和TRIF 依赖(TIR domain containing adaptorinducing interferon-Bdependent)的两条信号转导途径,最终激活转录因子入核,启动I型干扰素、抗菌肽、炎症细胞因子、趋化因子的表达以及MHC分子和共刺激分子的上调表达。固有免疫信号通路激活的最终效应是局部快速的抗感染效应分子的分泌以直接抵抗病原微生物、炎症细胞因子和趋化因子的炎症趋化效应和APC抗原提呈功能的显著上调。
固有免疫PR通路激活所产生的不同类型的细胞因子格局,显著影响了局部感染免疫早期效应并调节Thl细胞、Th2细胞、Th17细胞免疫应答格局,从而影响疾病的发生发展,如局部高水平的IL-12和IFN-γ显著激活Thl细胞分化,有助于清除病毒感染;而IL-6和TGF-B则激活炎症性Th17细胞分化,可介导自身免疫炎症;TLR9等激活不足,可能导致免疫耐受的发生;而TLR2与TLR4的过度激活则可导致急性移植排斥反应和自身免疫性炎症疾病的发生。
目前人工合成的各类TLR配体,如CpG、polyI:G等,已被积极用于候选疫苗新型佐剂的开发(表2.3),有效调控疫苗免疫应答的方向和强度(Hajam et al. , 2017)。
表1.TLR天然配体和激动剂
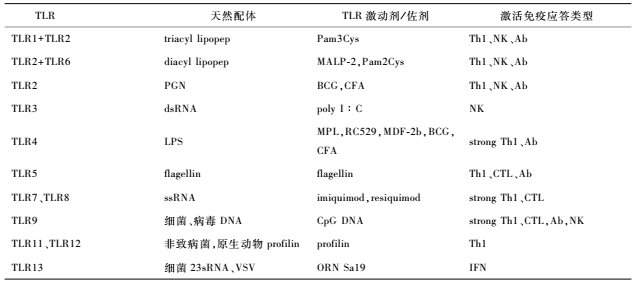
TLR激动剂是不同的TLR天然与合成激动剂,有利于调节DC和巨噬细胞的抗原提呈功能和炎症因子格局,从而诱导后续Thl细胞、Th2细胞、Th17细胞应答及特异抗体的类别转换。
鞭毛蛋白(flagellin)与DC表面的TLR5相作用,可显著增强Th1细胞、Th2细胞及Th17细胞应答,鞭毛蛋白靶抗原融合蛋白免疫,可显著增强细胞及体液免疫,特别可显著增加黏膜sIgA分泌。目前鞭毛蛋白作为流感疫苗佐剂已进入II期临床试验。
咪喹莫特(imiquimod)和瑞喹莫德(resiquimod)分别是TLR7和TLR8配体的小分子核苷类似物,咪喹莫特乳膏在临床上被用于治疗利什曼溃疡和细胞基底癌等,其通过激活TLR7通路,激活APC分泌IL-1、IL-6、IL-12、IFN-Y、TNF-α,促进皮肤朗格罕细胞迁移至引流淋巴结,增强固有免疫和细胞免疫。
细菌和病毒DNA富含免疫激活序列(ISS)-非甲基化CpG寡核苷酸序列。CpG作为TLR9激动剂,通过下游信号可激活DC和巨噬细胞分泌IFN-α、IFN-β、IL-12,可有效激活Thl细胞和CTL应答,促进抗病毒保护效果。
RLR或NLR激动剂:NLR识别的配体主要是细菌来源肽聚糖(peptidoglycan)和胞壁酰二肽(MDP)。MDP合成类似物如胞壁酰三肽(MTP)和磷脂酰乙醇胺,MTP具有Thl细胞佐剂作用;RIG-I识别病毒来源dsDNA和dsRNA,激活产生IFN-α、IFN-β。脊髓灰质炎病毒疫苗、牛痘疫苗、狂犬病疫苗富含dsRNA,因此接种后可分泌大量IFN-α、IFN-β,抗病毒同时促进免疫细胞趋引至局部,增强特异性免疫应答。dsRNA的类似物poly1:C,可显著增强IFN-α、INF-B分泌,促进抗病毒免疫保护。
参考来源:《当代新疫苗》(第二版)
InMed编辑部整理
湖南派智生物
派智生物,致力于新一代蛋白质纳米颗粒(VLPs)、亚单位疫苗研发,用“精准动物疫苗”呵护世间生灵。
扫码关注我们!
